这真是个巨大的突破,突破了原有减毒活疫苗的设计框架,等于是直接开创了新的疫苗制备体系,前景不可限量。
Generation of influenza A viruses as live but replication-incompetent virus vaccines
【0】首先简单介绍一下背景:(甲型)流感病毒(influenza A virus)是分节段的单负链 RNA 病毒,总共 8 个片段,负链的意思是与 mRNA 的顺序刚好 5'到 3'反向互补,IAV 也是反向遗传学体系非常成熟的模式病毒之一。IAV 的 8 个片段编码的基因分别是血凝素 HA、神经氨酸酶 NA、基质蛋白 M、核蛋白 NP、非结构蛋白 NS,还有 PA、PB1 和 PB2 三个蛋白组合起作为病毒的 RNA 依赖的 RNA 聚合酶(RdRp);
对于反向遗传学操作,现在一般是8 质粒系统,也就是子小答案里说的,8 个基因片段构建的双向载体,可以同时翻译蛋白和转录出负链基因组,所以,转染 8 质粒就可以获得流感病毒了,这一点是文章里对病毒进行突变的基础。
还有几个专有名词可能对理解有帮助——
CPE:致细胞病变效应,一般用来评价病毒的增殖情况,通常的特征有细胞变圆,肿胀,脱落,或者融合形成多核巨细胞等等。
质粒:如果这个不清楚,那.......
LD50:半数致死量,比方说病毒 100 倍稀释的时候,每只动物接种 1ml 会死一半,这个滴度就是病毒的 LD50;
PFU:空斑形成单位,病毒感染性颗粒的计量单位;
血凝抑制: hemagglutination inhibition (HAI) ,流感病毒的 HA 蛋白叫做血凝素,可以凝集鹅血球,而如果人的血清中有针对 HA 的抗体的话就可以抑制 HA 诱导的血凝现象,这种现象叫做血凝抑制;具有该作用的抗体叫做血凝抑制抗体。
中和:neutralization (NT),中和抗体,顾名思义,也就是血清中具有中和病毒的抗体,被中和的病毒就失去了感染性。
详细细节可以参考:
知乎专栏- 巴尔的摩分类体系;
只有病毒 DNA 或 RNA 的情况下是否能复制完整的病毒出来?
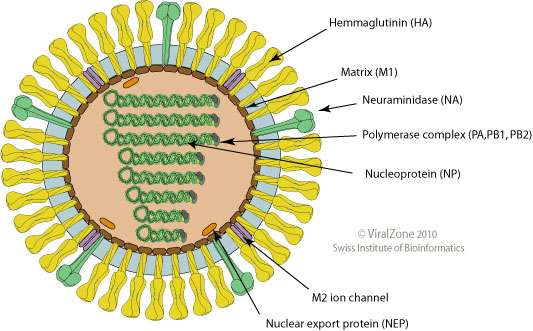
【图片来自 viralzone】
【1】作者首先是构建了一株细胞系,把正交翻译系统(orthogonal translation system),导入到人胚肾 293T 细胞中,使用的正交系统用的是 正常情况下 20 个氨基酸以外[orthogonal unnatural amino acid (UAA)]的 Nε-2-azidoethyloxycarbonyl-L-lysine,配对的系统是 Methanosarcina barkeri MS pyrrolysyl tRNA synthetase(tRNA 合成酶)/ tRNACUA,同时这个细胞里面有一个绿色荧光蛋白(GFP),但是在位置有一个被修饰的位点,在普通细胞中 39 位就是 TAG 终止了,但是在这个细胞系里,也就是不添加UAA(Nε-2-azidoethyloxycarbonyl-L-lysine)的时候,GFP 是不表达的【下图 B】,但是添加 UAA 之后,这个终止密码子就可以翻译了,也就是加入 UAA 细胞就变绿了。而且这个细胞系构建出来后比较稳定,增殖 200 代这些表型也没问题。而且,用这个细胞转染 8 质粒系统产生的流感病毒与正常的细胞产生的流感病毒在滴度上没有差别【下图 C】;
下边开始就是重头戏了,利用这个正交系统的 293T 细胞,作者在流感病毒 NP 上随机选了一个位点(Asp101),进行了突变,也就是说在普通细胞中转染 8 质粒系统的时候 NP 是不完整的,不能翻译出 NP,所以这个突变后的 NP 质粒,只有在正交系统 293T 细胞中才能产生流感病毒。作者称为PTC virus(premature termination codon),在这个细胞中添加 UAA,病毒是可以包装出来的【下图 D】,而且也只能在这个细胞添加 UAA 的情况下才能出现CPE【下图 E】。
所以作者构利用 8 质粒系统,在 NP 上添加终止码之后,只能在正交系统 293T 细胞添加 UAA 的情况下包装出来病毒,而且这个病毒的 NP 基因组也是有终止码突变的,也就是说在正常细胞中并不能复制【下图 A】。
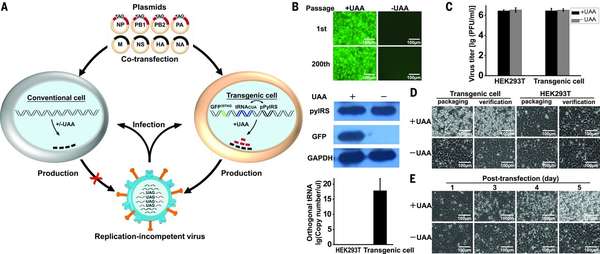
Fig. 1
Establishment of a virion packaging system that is compatible with the orthogonal translation machinery.
【2】我们知道流感和艾滋的疫苗为什么难弄,就是因为基因组的突变快,导致抗原变异,那么会不会这种终止码突变的毒株也会突变回来呢?
作者为了验证这个问题,就在 NP 随机突变了好多个三连码位点【下图 A】,然后发现这些突变的病毒增殖的动力其实区别不大【下图 B】,而且都不能在正常细胞上复制【下图 C】。除了 NP 之外,流感不是 8 质粒吗,作者又在除了 HA 和 NA 之外的质粒上进行了突变(这两个是主要的中和抗体靶标),结果也都差不多,只在 HA-Lys57, NS-Phe103, PB2-Gln13, PB2-Thr35, M2-Lys49, and M2-L 等位点上回复突变率要高几个数量级,并最终逃脱了 UAA 依赖。
所以,既然有回复突变的可能,那么是不是在设计的时候就多用几个同时突变的终止位点不就能大大降低回复概率吗?——单点突变的回复突变率是 1.0 × 10−8 (PTC-1), 双点突变是 1.2 × 10−10 (PTC-2), 三点突变就基本上检测不到了 (<10−11)【下图 C】。
再进一步,作者想看看在(动物)体内的回复突变的可能,作者选了一个毒株(PIC-4A)作为代表【下图 4D+E】,在小鼠、豚鼠和雪貂上进行实验(常用的流感动物模型);
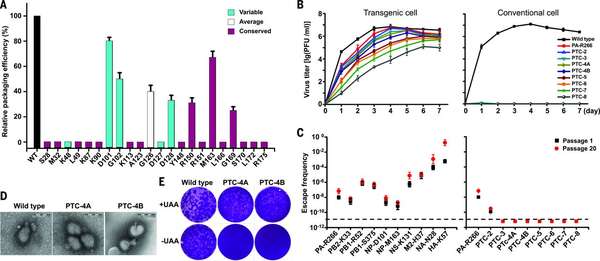
Fig. 2
Genome-wide investigation and characterization of the PTC influenza viruses.
【3】在小鼠模型中,WSN 毒株通常在半数致死量是 8 × 10E3 PFU,而用 10 倍 LD50 的时候(也就是 8 × 10E4 ),小鼠会全部死亡【下图 A 左】,而且体重会显著降低。但是 PTC-4 对照组中,这种病毒即使用到了 10E9 PFU,也就是比正常 LD50 高 10E5,都不会有小鼠死亡,体重也不会减轻【下图 A 右】。攻毒三天后小鼠各脏器的病毒载量,PTC-4、减毒活疫苗(温度敏感株)和野毒株在鼻 turbinate, 气管 trachea 和肺脏 lung 里的病毒载量分别是 10E1.6, 10E1.5, and 10E1.3 PFU/g 、10E3.5, 10E2.9, and 10E1.8 和 10E5.5, 10E5.7, and 10E6.5【下图 B】。
前面也说了,PTC-4 这种密码子突变的病毒在正常细胞上是不会复制的,所以在正常细胞中也不会产生空斑【下图 C】,在正交细胞添加 UAA 的情况下才有空斑形成。
而且,在同笼培养的豚鼠中,接种过 PTC-4 的豚鼠并不会把病毒传染给其他未接种的豚鼠,而在野生型和减毒疫苗组中,这是普遍现象(流感毕竟是空气传播的);
所以说,三种动物的实验都证实了突变病毒是非常安全的。
Fig. 3
Characterization of the in vivo safety of the PTC viruses.
【4】既然突变病毒很安全,也基本不会回复突变,那么作为疫苗来说免疫效果咋样呢?
作者比较了 PTC-4A 和灭活疫苗IIV(inactivated influenza vaccine)以及减毒疫苗 CAIV。
10E6 PFU 免疫小鼠,10E7 PFU 免疫雪貂和豚鼠。三周后,全病毒疫苗—— PTC-4A 和 CAIV 免疫后的血清都具有强烈的血凝抑制 /HAI和中和 /NT效应;而灭活疫苗即使在免疫两次后效果也不明显【下图 A 左 1+2】。
而 PTC-4A 在此免疫后,可以诱导血凝抑制抗体和中和抗体水平上升 6~8 个级别(如果是 2 倍倍比稀释的话,倍数也就是 64~256 倍)【下图 B】。而且黏膜免疫的主要抗体 IgA 只在 PTC-4A 和 CAIV 上被诱导出来,而灭活疫苗没有(很好理解,因为只有活病毒才有类似正常感染的效果)【下图 A 右 2】。
好,因为抗体都是体液免疫应答,对于病毒感染来说,细胞免疫应答也很重要,这部分主要是杀伤性的 T 细胞(cytotoxic T lymphocytes/CTL),PTV-4A 和 CAIV 诱导的 CTL 是灭活疫苗的 10 倍以上,灭活疫苗只在肺部具有正基线水平的 CTL【下图 A 右】。
好,那既然纸面上的免疫效果这么好(抗体和 CTL,做疫苗最常用的指标),但是,既然作为疫苗,最主要的还是要看保护效果,所以,最后一点是看 PTV-4A 的保护效果,还是跟灭活苗和减毒苗相比较。每组 15 只,免疫 3 周后,动物经鼻腔攻毒 50 倍 LD50 的野生型病毒,攻毒 3 天后,每组处死 5 只,用于滴定肺部的病毒载量;在减毒苗和 PTV-4A 的免疫组,尤其是两次免疫组,病毒滴度下降了 1000 倍,体重也没啥变化,而且所有 PTV-4 和 CAIV 组的剩余动物全部存活【下图 D】;
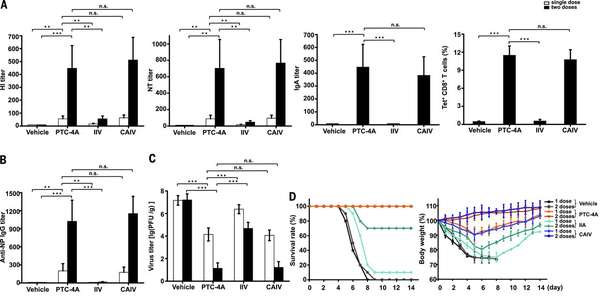
Fig. 4
Characterization of the immunogenicity and protective efficacy of the PTC-4A virus in BALB/c mice that were intranasally inoculated with one or two doses.
【5】作者又测试了,这一种突变病毒是不是对其他抗原类别不一样的流感病毒也有保护作用(大家应该也清楚什么 H9N1,H5N6,H5N1,H1N1 等等,这些都是不同的抗原型别),15 只小鼠,单次免疫 PTV-4A,再用 10E6 PFU 的重组 H1N1 或者 H3N2( influenza A/reassortant/NYMC X-179A (pH1N1) or A/Aichi/2/68 (H3N2) viruses)来攻毒,结果发现保护效果也很好,病毒滴度降的也多,这可能是共同的保护抗原和病毒特意的 CTL 起到的保护作用。
其实到这一步文章已经非常完美了,但是这篇文章居然还有一个更为亮点的信息。
因为对于其他正常的减毒活疫苗来说,跟野生病毒混合,会恢复原来的毒性。但是作者发现,把 PTV-4A 跟野生型病毒去混合,反而大大降低了原来病毒的滴度,这应该就是不同的基因组会重组,但是野生型的重组了 PTV-4A 的突变基因组反而把自己的复制能力给丧失了。这就有意思了,也就是说这种疫苗还具有治疗性的作用!
【5】总结
Our results show that we succeeded in generating live but replication-incompetent virus vaccines by applying genetic code expansion to the influenza virus genome. Such live vaccines elicited robust immunity against both parental and antigenically distinct strains. Generation of such PTC virus vaccines can be potentially adapted to almost any virus (27) so long as their genome could be manipulated and packaged in a cell line. Furthermore, the multiple PTC-harboring viruses are not only prophylactic but also therapeutic vaccines in the neutralization of the replicating viruses.
原文的总结贴出来了,其实就是两条,非常 impressive。
第一——只要是能反向遗传操作的病毒,都能这样用特殊细胞系来制备疫苗,太帅了。
第二——疫苗不光能发挥预防作用,还能发挥治疗作用,更帅了。


 狗仔卡
狗仔卡 发表于 2016-12-4 10:09 AM
发表于 2016-12-4 10:09 AM


 提升卡
提升卡 置顶卡
置顶卡 沉默卡
沉默卡 喧嚣卡
喧嚣卡 变色卡
变色卡