是时候祭出我这张课件图片了。
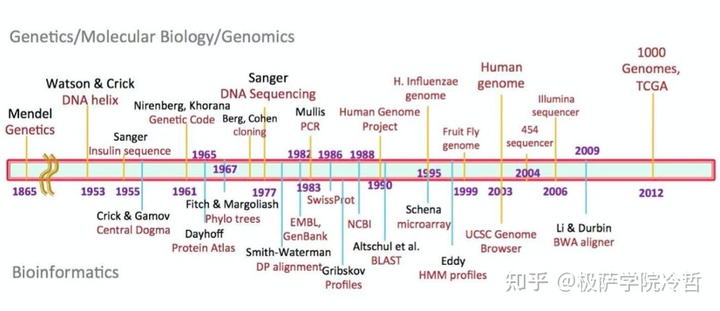
时间轴上记载的是遗传学 / 分子生物学 / 基因组学以及生物信息学的在从 1865 到近代的一些标示性事件的时间点。
虽然这些都是生命科学领域的进展,但是,正式这些进展,极大的推进了医学的进步,解决了非常多医学上的大问题。
比如举一个最简单的例子,在时间轴上不起眼的 PCR 技术,成为了我们现在所不可或缺的新冠病毒检测的金标准的理论基石。同样这个技术在 1993 年获得了诺贝尔化学家。
今天想跟大家的分享的,是这个时间轴里,我认为近代生命科学最重要的一个事件,同时也是对人类的近代医学有着非常非常大影响的事件——人类基因组计划。
人类基因组计划(The Human Genome Project,HGP)是一个可以与曼哈顿原子弹计划和阿波罗登月计划并列的,人类在 20 世纪的三大科学计划之一。人类基因组计划其目的在于对一个人完成完整的序列测序,病绘制人类基因图谱,以达到破解人类遗传学信息的最终目标。
人类基因组计划从提出到实现到最终结束,耗时十几年,几十亿美金,同时由中国、美国、英国、法国、德国、日本等多国科学家合力完成。这可以说是一个科学史上的壮举。
我甚至都怀疑,在当下的国际环境下,下一个能让这么多国家联合起来进行的大型科研项目就是如何解决三体人的入侵了。
从我们对人类自身基因的认知来说,早在 1865,孟德尔的年代我们就发现了遗传学的一些规律,后续我们也发现了一些疾病是具有遗传的情况的,但这个情况如何判定?是什么让这些疾病具有有遗传因素我们不得而知。
直到后来我们确认了 DNA 是人类的遗传物质,以及沃森和克里克提出 DNA 的双螺旋结构,我们也只是认知到我们的所有遗传信息的奥秘都会在这个双螺旋结构之中,但具体是什么呢?
在接下来的时间里,我们尝试着破解了一些简单的生物,比如病毒和一些模式生物的基因序列,我们发现了大量的存在于 DNA 中的密码。于是逐渐有科学家提出,我们能否完成一人类的基因图谱的测序,也就是说对一个人来进行基因测序呢?
但这个工程对于当时的技术来说太浩大了,大到任何一个实验室或者研究机构,在这项工程面前,就像是试图搬山的愚公。
比如我们现在认知的新冠病毒,只有 3 万个左右的碱基长度,而一个人是有 30 亿个碱基长度。这在当时看来绝对是一个天文数字。
但越来越多的硬性需求摆在了人类的面前,遗传学几乎遇到了不可逾越的天花板,同时科学家也在 Science 上发文指出,人类基因组测序将成为我们对肿瘤治疗的最关键突破口。
于是在 PCR 技术,分子克隆技术以及 DNA 测序技术等进一步发展的前置条件之下,人类开始了近代生命科学历史的最大的征程,开启了人类基因组计划。用现在的话说,那目标定的,真的是星辰与大海。
今年,也正好是人类基因组计划草图发表 20 周年,Nature 和 Science 分别发布了专刊,来纪念这 20 年的我们在 HGP 上的进展和收获。

那么,20 年后,人类基因组计划对我们带来了那些改变呢?
首先,从人类基因组带来的一个直观收获就是,我们发现了大批的人类新的基因,而寻求这些基因背后所携带的信息成了近代基因组学等多组学的长远任务。而这项任务带来了非常非常多的成果。
比如从遗传学上来看,我们的对于人类的许多基因都有了深入的探索。比如遗传病,尤其是单基因遗传病,像是白化病,鼠尿病,地中海贫血等等这些疾病的致病基因我们都有了非常深入的研究。
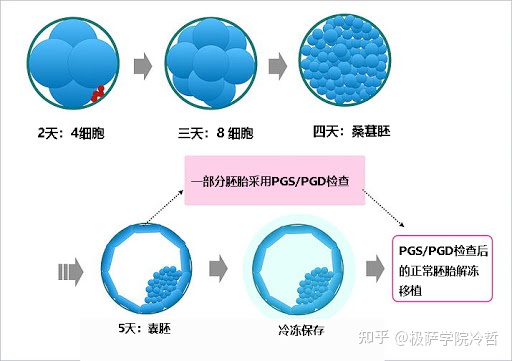
虽然我们现在还很难对这些基因进行治疗和修复,但我们可以在婚前对新婚夫妇进行基因测序,来预测他们是否有可能生出携带某些先天性遗传疾病的宝宝,从而考虑是否需要进行人工干涉。结合这试管婴儿技术,我们已经可以在生育前进行人工干涉,使得携带有遗传疾病基因的人群诞生健康的宝宝。
我们发现许多我们认为并不是遗传性疾病的病因其实与我们人类的基因也息息相关。比如高血压,糖尿病,甚至是艾滋病感染其实都跟人类本身的基因有直接关系。
举个例子,我们现在正在全球大流行的 COVID-19,同样的 Sars-Cov-2 病毒感染,不同人的症状和严重程度都会不同,除了病人自身的身体情况以外,我们还发现从基因层面上也有着非常多的影响,关于这种研究,我们叫做宿主特异性基因研究。
这也就引发了 HGP 对医学的最大的改变——精准医学的诞生。
中国传统医学就讲“辨证施治、一人一方”,那么在精准医学里边,这个概念被非常精细化的定义了。对于同一种疾病,但是因为基因型的不同,采取不同的治疗方式。
这点最显著的应用就是在癌症治疗上。
人类基因组计划在诞生之前就有一个目标是解决肿瘤的问题,而且也切实的解决了非常多肿瘤治疗的难题,甚至可以说,近代的癌症治疗的根基,都是建立在人类基因组计划的基础之上。
比如我们现在推荐癌症患者去做一个基因检测,目的是什么呢?一是从基因层面上确定癌症的分型,二是寻找对应的靶向药物。
癌症是一个极其复杂的疾病,以肺癌举例,世界卫生组织(WHO)按组织学分类将肺癌分为:小细胞肺癌(SCLC)、大细胞癌(LCC)、鳞状细胞癌(SCC)及腺癌(ADC)。而即便是同一种肿瘤,因为其基因不同所对应的靶点也有很大区别。
还是以肺癌举例,如大部分 EGFR 野生型的肺癌患者使用吉非替尼(易瑞沙)、厄洛替尼(特罗凯)效果不显著;而携带 EGFR 基因 18 号外显子阳性突变的肺癌患者使用吉非替尼(易瑞沙)、厄洛替尼(特罗凯)和阿法替尼则效果显著,但假如肺癌患者同时携带 EGFR 基因 18 号外显子和 HER2 基因阳性突变时,使用吉非替尼和厄洛替尼很可能效果不佳,而阿法替尼作为 EGFR 和 HER2 的双重抑制剂,对于同时携带 EGFR 和 HER2 基因阳性突变的肺癌患者是有效的。
而且即便根据不同肿瘤细胞的靶点找到了对应的靶向药物,但还会出现肿瘤细胞产生对应的耐药性问题,比如所有携带 EGFR 突变并使用 EGFR 酪氨酸激酶受体抑制剂(TKI)治疗的肺癌患者都会产生获得性耐药。常见机制包括 EGFR 基因 20 外显子 T790M 突变、MET 及 HER2 基因的扩增。此外,还有 EGFR 罕见突变(D761Y、T854A 等)、EGFR 扩增、PIK3CA 突变等。
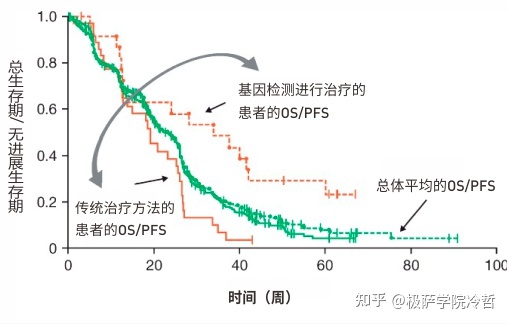
从数据来看,根据基因检测进行治疗的肺癌患者总生存期(OS)及无进展生存期(PFS)都有明显的提高。
所以基因测序对于肺癌的治疗是起到了非常积极的效果的。
那么针对与其他癌症,因为癌症的复杂性,在有一些情况下能起到相应的作用。要根据具体的情况来分析。
同时因为肿瘤靶向药物种类繁多,包括 FDA 和 NMPA 批准上市的就有接近 100 种以上,同时还有近百种的二三期临床药物。如果让医生逐一尝试就确实太难了,所以即便二代测序在肿瘤靶向药物筛选上价格不那么便宜,但针对后续的病情来看,还是挺值得一做的。哪怕找不到已经上市的靶向药物,有了这个数据也可能会患者提供一个临床试验入组的机会。
而这些仅仅是一个开端,我们现在已经不再满足于去发现新的致病基因,而是想办法从基因层面去治疗这些疾病,从 2017 年第一款基因治疗药物上市到现在,其中已经有多款治疗药物上市,2019 年 12 月,Nature 发表了题为:Gene Therapy Arrives 的文章,揭示了一个新的基因治疗层面的到来。
举个大家大家可能听说过的例子,全世界最贵的药物,Zolgensma。
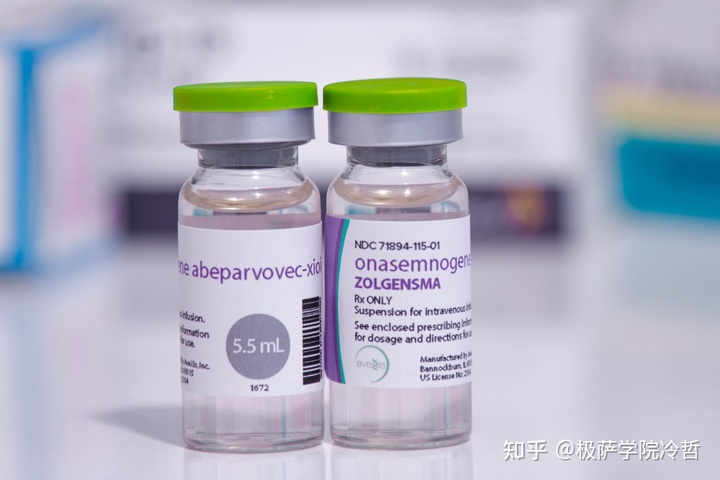
Zolgensma 于 2019 年获得 FDA 批准,由诺华公司研发,用于治疗 2 岁以下患有存活运动神经元 1(SMN1)等位突变导致的脊髓性肌萎缩症(SMA)的儿童患者。脊髓性肌萎缩症(SMA)是一种非常罕见的神经肌肉遗传疾病,全世界仅有约 10000 人患病。诺华公司开发的这款疗法,是通过腺相关病毒(AAV)将正确的人类 SMN1 基因递送到患者神经元,从而恢复患者的运动能力。该疗法售价高达 210 万美元(约合 1400 万人民币),成为了目前世界最昂贵的药物。
可见的未来的一段时间内,相信会有大批的基因治疗药物上市,虽然现在可能价格昂贵,但相信未来总有一天会降下来。要知道当年的人类基因组计划花费了几十亿美金,十几年的时间。而现在我们测一个人的全基因组只要几万元和几周的时间。
人类基因组计划草图发布 20 年后的今天,我们对于基因的了解仍然有很多不足和未知,但可以说相比 20 年前我们已经有了质的提升。我们从发现新基因,到编辑基因,甚至到未来的创造基因,我们在这一领域愈发的向造物主的方向接近。
人类,也将走上一条新的进化之路。


 狗仔卡
狗仔卡 发表于 2021-5-20 02:07 PM
发表于 2021-5-20 02:07 PM

 提升卡
提升卡 置顶卡
置顶卡 沉默卡
沉默卡 喧嚣卡
喧嚣卡 变色卡
变色卡